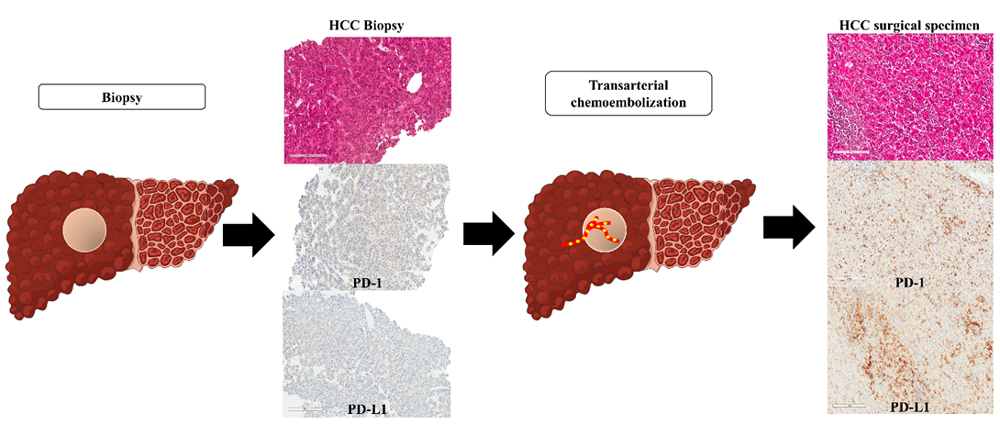
Les immunothérapies représentent une nouvelle approche thérapeutique alternative pour les carcinomes hépatocellulaires (CHC), et ont montré des résultats prometteurs lorsqu’elles sont utilisées en thérapie combinée. L’objectif de cette étude était d’évaluer le potentiel de la chimio-embolisation transartérielle (TACE) pour moduler les profils d’expression de programmed death-1 (PD-1) et programmed death-ligand 1 (PD-L1) dans une cohorte de CHC traités chirurgicalement.
Un total de 82 CHC traités chirurgicalement provenant de patients ayant subi (n = 32) ou non (n = 50) une TACE préopératoire ont été inclus dans l’étude. L’expression immunohistochimique de PD-1 et de PD-L1 a été analysée et comparée en fonction du traitement TACE. Les biopsies pré-traitement, qui étaient disponibles pour 30 cas (20 avec TACE et 10 sans), ont été analysées de la même manière. Les données de suivi ont été récupérées dans les dossiers des patients.
Une expression de PD-1 (≥1%) dans les cellules inflammatoires intratumorales (CI) a été observée dans 46% des CHC, et une expression de PD-L1 (≥1%) dans les CI et une expression de PD-L1 dans les cellules tumorales (CT) ont été observées dans 46% et 16% des CHC, respectivement. Un faible niveau d’expression de PD-1 (<1%) était associé à une surexpression forte et diffuse de la glutamine synthétase (8% contre 27%, P = 0,024). Les CHC provenant de patients ayant reçu un prétraitement par TACE ont montré une expression de PD-L1 significativement plus élevée dans les CT que ceux provenant de patients n’ayant pas reçu de prétraitement par TACE (2 % contre 0,4 %, P = 0,027). L’expression de PD-1 dans les CI et l’expression de PD-L1 dans les CI et les CT étaient plus élevées dans les tumeurs réséquées par TACE que dans les biopsies correspondantes avant TACE (respectivement : 1,8% contre 8,1%, P = 0,034 ; 0,8% contre 7,1%, P = 0,032 ; et 0% contre 2,4%, P = 0,043).
Nos résultats, montrant une augmentation de l’expression de PD-1 et de PD-L1 dans les CHC après TACE, soutiennent l’utilisation de TACE en combinaison avec l’immunothérapie dans des cas sélectionnés pour optimiser la réponse tumorale.